Для более подробного представления о примесях четвёртой группы в природной воде проводится изучение её ионного состава. Основные катионы, определяющие солесодержание природных вод: Ca2+, Mg2+, Na+, K+, а основные анионы – HCO3-, SO42-, Cl-. Остальные элементы, хоть и находятся в воде в незначительных количествах, могут существенно влиять на её качество.
Уравнение электронейтральности природной воды записывается как равенство сумм перечисленных ионов:
[Ca2+]+[Mg2+]+[Na+]+[K+] = [HCO3-]+[SO42-]+[Cl-]
Соотношение концентраций единичных ионов в воде зависит от общей минерализации. Малосолёные воды рек и пресные подземные воды в наибольшей мере содержат ионы кальция и гидрокарбонат-ионы. С увеличением солесодержания увеличивается доля натрия, калия, сульфатов и хлоридов. Сумма ионов [Ca2+]+[Mg2+], определённая в мг-экв/дм3, выражает общую жёсткость воды.
Ионный состав природной воды определяет один из самых важных показателей её качества – общая щёлочность, которая является суммой анионов слабых кислот, способных реагировать с сильными кислотами (серной или соляной). В зависимости от ионного состава общая щёлочность включает бикарбонатную, карбонатную и гидратную её части. Водородный показатель (рН) большинства природных вод находится в пределах 6,0-8,3 ед. рН, поэтому в таких водах наибольшую часть щёлочности составляет её бикарбонатная часть (из-за преобладания аниона HCO3-). При значениях рН более 8,3 ед. увеличивается доля карбонатной щёлочности на фоне уменьшения бикарбонатной, а при рН более 9, появляется ещё и гидратная составляющая.
При графическом изображении ионного состава природных вод, концентрации определяются шириной полосы, катионы указываются сверху, а анионы снизу, при этом анионы располагаются в порядке увеличения их кислотных свойств, а катионы – в порядке образования малорастворимых соединений при постепенном увеличении водородного показателя: Ca2+->Mg2+->Na+->K+, HCO3-->SO42-->Cl-
Увеличение водородного показателя и, как следствие, щёлочности воды является основой процессов реагентного умягчения и обезжелезивания воды с помощью аэрации и/или известкования.
Составляющие щёлочности – бикарбонаты, карбонаты – есть не что иное, как соединения угольной кислоты, которые вместе ионами кальция образуют карбонатно-кальциевую систему равновесий, которая оказывает огромное влияние на свойства и качество природных вод.
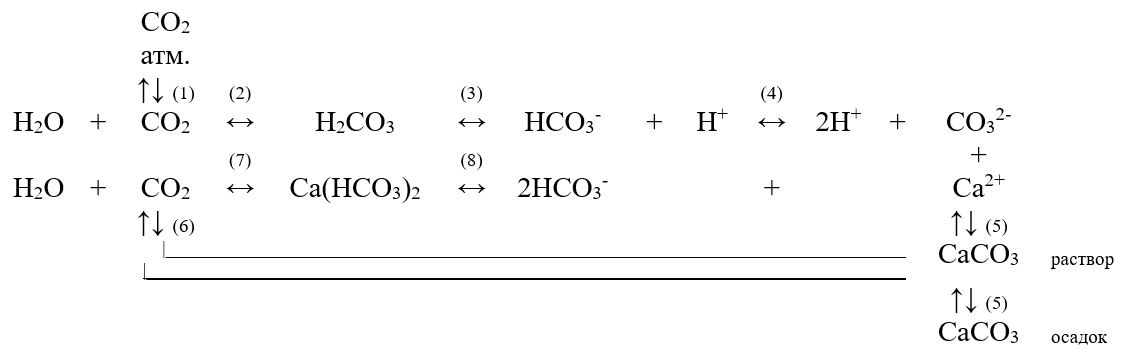
В условиях равновесия конкретному содержанию бикарбонатов соответствует определённая концентрация свободной угольной кислоты (равновесной углекислоты). При этом вода находится в стабильном состоянии, в ней не происходит ни растворения карбонатов, ни выпадения их в осадок.
При увеличении концентрации растворённой углекислоты сверх равновесной концентрации, реакция (7) сдвинется вправо, будет происходить растворение карбоната кальция. Избыток углекислоты в воде больше её равновесной концентрации называется агрессивной углекислотой, что, например, в соприкосновении с бетонными ограждениями будет приводить к вымыванию из них карбоната кальция.
Реакция (7) будет протекать справа налево, при этом малорастворимое соединение CaCO3 будет выпадать в осадок.
Стабильность воды определяется как индекс насыщенности воды соединением CaCO3 (один из вариантов - индекс Ланжелье) при определённой температуре, солесодержании, ионов кальция и общей щёлочности.
